《Annalsof Oncology》于2021年4月27日在线发表了KATHERINE研究的亚组分析,KATHERINE研究是改变HER2+乳腺癌治疗模式的里程碑研究之一,从既往的辅助治疗模式,到了新辅助后通过pCR状态调整后续的治疗策略。

背景:在KATHERINE研究(NCT01772472)中,与曲妥珠单抗相比,新辅助化疗(NACT)联合HER2靶向治疗后存在浸润性残留病灶的早期乳腺癌(EBC)的患者接受辅助T-DM1治疗后复发或死亡的风险降低50%。本次报道探索性安全性和疗效分析。
患者和方法:KATHERINE入组了NACT后手术时乳腺/腋窝残留浸润性疾病的HER2阳性EBC患者,NACT含紫杉烷(±蒽环类药物,±铂类)和曲妥珠单抗(±帕妥珠单抗)。患者随机接受辅助T-DM1(n = 743)或曲妥珠单抗(n = 743)治疗14个周期。主要终点是侵袭性无病生存期(IDFS)。
结果:无论新辅助紫杉烷类型如何,周围神经病变的发生率相似。基线周围神经病变与周围神经病变持续时间长(中位数,长105-109天)和缓解率较低(∼65%vs∼82%)相关。在T-DM1组中,既往铂类药物治疗与更多的3-4级血小板减少症相关(13.5%vs 3.8%),但在这些患者中未发生≥3级出血。在接受以蒽环类药物为基础的NACT(HR = 0.51;95%CI:0.38-0.67)、非以蒽环类药物为基础的NACT(HR = 0.43;95%CI:0.22-0.82)、分期cT1、cN0肿瘤(0 vs 6例IDFS事件)或具有特别高危的肿瘤(HR范围为0.43-0.72)的患者中,与曲妥珠单抗相比,T-DM1降低了复发或死亡风险。T-DM1组中中枢神经系统(CNS)更常为首次复发部位(5.9%vs 4.3%),但T-DM1与CNS复发总体风险的差异无关。
结论:T-DM1在各个患者亚组中显示临床获益,包括小肿瘤,尤其是高风险肿瘤,不会增加CNS复发的总体风险。NACT类型对安全性的影响极小。
主要研究结论的支持数据:
在安全性人群中,T-DM1组治疗期间出现的周围神经病变的发生率(32.3%)高于曲妥珠单抗组(16.9%)


治疗组之间接受新辅助治疗的紫杉类型相似,包括多西他赛(T-DM1组,54.3%;曲妥珠单抗组,57.1%)、紫杉醇(47.4%;44.3%)和白蛋白结合型紫杉醇(0.8%;0%)。无论接受的新辅助紫杉烷类型如何,每个治疗组内治疗期间出现的周围神经病变的发生率相似。与≤12周相比,在接受紫杉烷治疗 > 12周的患者中观察到≥2级周围神经病变在数值上增加(T-DM1组9.5%vs 4.7%;曲妥珠单抗组2.2%vs 1.1%;表1)。
治疗后出现血小板减少症的患者在安全性人群中,T-DM1治疗后出现的血小板减少症的发生率(28.5%)显著高于曲妥珠单抗(2.4%)(表a.2)。19.9%的患者接受了含铂新辅助治疗方案(T-DM1,19.1%;曲妥珠单抗,20.8%)。在T-DM1组中,既往铂类药物治疗与3级(既往铂类药物治疗8.5%,无铂类药物治疗2.5%)和4级(既往铂类药物治疗5.0%,无铂类药物治疗1.3%)血小板减少症发生率较高相关。然而,无论既往铂类药物治疗如何,3-4级血小板减少的中位持续时间和缓解率相似(表2),在接受铂类药物治疗的患者中未发生≥3级出血。

CNS复发患者尽管T-DM1组的总体IDFS事件发生率低于曲妥珠单抗组(12.2%vs 22.2%),但在T-DM1组中观察到CNS作为首次复发部位的发生率在数值上更高(5.9%vs 4.3%)。然而,T-DM1组(6.1%)和曲妥珠单抗组(5.4%)在任何时间的CNS复发总体发生率相似(表3)。与曲妥珠单抗组患者相比,T-DM1组患者更有可能将CNS复发作为其唯一复发部位(4.8%vs 2.8%),至CNS复发的中位时间更长(17.5 vs 11.9个月)。两个治疗组CNS复发后的中位总生存期相似(T-DM1为12.5个月,曲妥珠单抗为14.3个月;图A.1A)。为估计CNS和非CNS事件作为首次IDFS事件的累积发生率,进行了竞争风险分析。与曲妥珠单抗相比,T-DM1显著降低了首次IDFS事件非CNS复发的累积发生率。两组作为首次IDFS事件的CNS复发累积发生率的微小差异可通过竞争风险解释


Figure1. Kaplan–Meier estimates of time to first invasive disease-free survival eventin patients who received (A) anthracycline-based neoadjuvant therapy or, (B)non-anthracycline-based neoadjuvant therapy.
大多数患者接受了基于AC的NACT治疗(76.9%),治疗组之间分布平衡。接受新辅助AC和未接受新辅助AC治疗的患者之间的一些患者特征不平衡(表A.3)。For instance, patients treated withAC-based NACT were less likely to have been treated in North America (11.0%versus 60.6%), were less likely to be Asian (7.4% versus 12.8%), and were morelikely to have had an Eastern Cooperative Oncology Group (ECOG) performancestatus of 0 (84.3% versus 72.0%) than those who received non-AC-based NACT.Patients who were treated with AC-based NACT were less likely to have beentreated with neoadjuvant tRAStuzumab in combination with Pertuzumab (9.8%versus 46.6%). Disease characteristics, including hormone receptor status andtumor stage, were similar between the subgroups.
无论是否使用新辅助AC,辅助T-DM1与曲妥珠单抗相比观察到的IDFS获益相似。(图1)。在基于AC的NACT组中,与曲妥珠单抗相比,辅助T-DM1的复发或死亡风险相对降低49%,在非基于AC的NACT组中降低57%,两者均与在总体人群中观察到的50%的风险降低相似。在两个亚组中,接受T-DM1的患者的3年IDFS无事件率均高于接受曲妥珠单抗的患者(在基于AC的NACT亚组中为87.4%vs75.7%;在非基于AC的NACT亚组中为91.7%vs 81.4%)。
基于AC和非基于AC的亚组之间的总体安全性特征基本一致(表4)。在两个亚组之间,T-DM1或曲妥珠单抗治疗时已知发生的大多数AE(即选定AE)的所有等级发生率相似,包括肝毒性、周围神经病变、出血、输注相关反应/超敏反应和心功能障碍。无论帕妥珠单抗是否为新辅助治疗方案的一部分,安全性数据均相似(数据未显示)。在T-DM1治疗的患者中,与接受基于AC的NACT的患者相比,接受非基于AC的NACT的患者报告了所有级别血小板减少(32.5%vs 27.4%)和肺毒性(6.7%vs 1.7%)的增加。除非AC为基础组1例(0.6%)3级肺毒性和AC为基础NACT组2例(0.3%)外,所有肺毒性均≤2级。此外,在非AC亚组和基于AC的NACT亚组中观察到T-DM1治疗后≥3级AE的总体发生率增加(39.9%vs 21.7%),≥3级血小板减少症(10.4%vs 4.3%)和外周感觉神经病变(4.3%vs 0.5%)的发生率差异最大。



按NACT方案(即,AC+紫杉醇、AC+多西他赛、紫杉烷+铂类)进行的安全性分析显示,无论接受哪种类型的NACT患者,曲妥珠单抗组中≥3级AE的发生率相似(表a.4)。然而,在T-DM1组中,接受紫杉烷+铂类药物治疗的患者≥3级AE的发生率更高。这主要是由于血小板减少症和周围神经病变的发生率较高。
尽管在既往接受过非AC NACT的患者中观察到T-DM1治疗后AE总体增加,但非AC亚组中因AE导致的T-DM1停药率仅略高于AC NACT亚组(19.6%vs 17.5%),因AE导致的T-DM1剂量降低也是如此(14.1%vs 11.6%)。
接受内分泌治疗(HT)的患者大多数(72.3%)是激素受体阳性、HER2阳性乳腺癌。无论激素受体状态如何,T-DM1的IDFS获益相似。T-DM1使激素受体阳性疾病患者(未分层HR = 0.48;95%CI:0.35-0.67)和激素受体阴性/未知疾病患者(未分层HR = 0.50;95%CI:0.33-0.74)的IDFS事件风险降低约50%。
在接受T-DM1治疗的患者中,接受HT和未接受HT治疗的患者≥3级AE(26.0%vs24.9%)、严重AE(12.9%vs 12.2%)和导致T-DM1剂量降低的AE(11.0%vs 15.0%)的发生率相似(表5)。然而,无HT组发生导致退出T-DM1的AE的患者多于HT组(22.5%vs 16.1%)。这主要由实验室检查异常驱动(13.6%vs 8.5%),其中大多数为低级别严重程度。除无HT组任何级别肝毒性(44.1%vs 34.5%)和出血(33.8%vs 27.3%)适度增加外,HT组和无HT组已知与T-DM1相关的AE发生率相似。几乎所有这些事件的严重程度均为低度,无HT组和HT组分别有1.9%和1.5%发生3级肝毒性,每组发生≥3级出血的比例均低于1%。




讨论
在KATHERINE的主要分析中观察到T-DM1和曲妥珠单抗之间的AE特征差异,包括所有级别和≥3级周围神经病变和血小板减少的发生率更高。在潜在治愈性EBC背景中,高级别和潜在长期AE尤为重要。在T-DM1的临床试验中报告了周围神经病变。既往研究表明,基线神经病变是化疗诱导的外周感觉神经病变的风险因素。此外,紫杉烷治疗与周围神经病变相关,一些数据表明多西他赛的发生率高于紫杉醇。在我们的分析中,接受T-DM1的基线周围神经病变(1级)患者2级和3级周围神经病变的发生率较高。然而,无论治疗组如何,基线周围神经病变均与周围神经病变持续时间较长和消退率较低相关,表明既存周围神经病变是一种风险因素,与HER2靶向治疗类型无关。接受的紫杉烷类型似乎不影响治疗期间周围感觉神经病变的发生率或严重程度,但既往紫杉烷治疗超过12周时≥2级事件略有增加。在我们的研究中,与接受紫杉烷+ AC的患者相比,在新辅助治疗背景下接受紫杉烷+卡铂的患者中观察到≥3级周围神经病变增加(表A4)。
T-DM1相关性血小板减少症也有广泛报道。最常见的严重程度为1-2级,血小板计数最低值发生在第8天,并在下一次给药时改善至0级或1级。由于卡铂治疗与血小板减少症相关,既往接受过铂类药物治疗的患者中所有等级T-DM1期间血小板减少的发生率增加(36%vs 27%);然而,既往接受过铂类药物治疗并不影响3-4级血小板减少的持续时间和消退,也未导致3-4级出血。
肺毒性的发生率普遍较低,仅发生在接受辅助放疗的患者中。然而,与曲妥珠单抗相比,T-DM1略高,包括2例3级放射性肺炎,均消退。
在KATHERINE中,T-DM1组首次IDFS事件CNS复发的发生率在数值上高于曲妥珠单抗组。表明,发生率增加是曲妥珠单抗试验中观察到的竞争风险的结果。具体而言,T-DM1观察到的首次事件非CNS复发发生率显著降低,导致CNS复发作为首次事件和唯一复发部位的可能性增加。我们的分析支持了这一假设,发现两组CNS复发的累积发生率相似,T-DM1组CNS复发时间延长5.6个月,T-DM1受体CNS复发作为唯一复发部位的发生率更高。重要的是,T-DM1组中CNS复发率作为首起事件在数值上更高似乎对CNS复发后的总生存期没有不利影响,T-DM1没有增加CNS复发的总体风险。尽管如此,在EBC患者中对HER2阳性CNS疾病发展有效的治疗仍然是未满足的治疗需求。令人鼓舞的是,最近发表的HER2阳性转移背景下的III期数据表明,在曲妥珠单抗和卡培他滨的基础上加用tucatinib可使脑转移患者的疾病进展风险降低52%。
无论NACT类型如何(AC vs非AC),T-DM1提供的临床获益与意向治疗人群中观察到的临床获益相似。
虽然队列较小,但辅助T-DM1似乎可使临床分期为T1、cN0的肿瘤患者获得临床获益,这些患者接受新辅助治疗但在手术时有残留病灶。
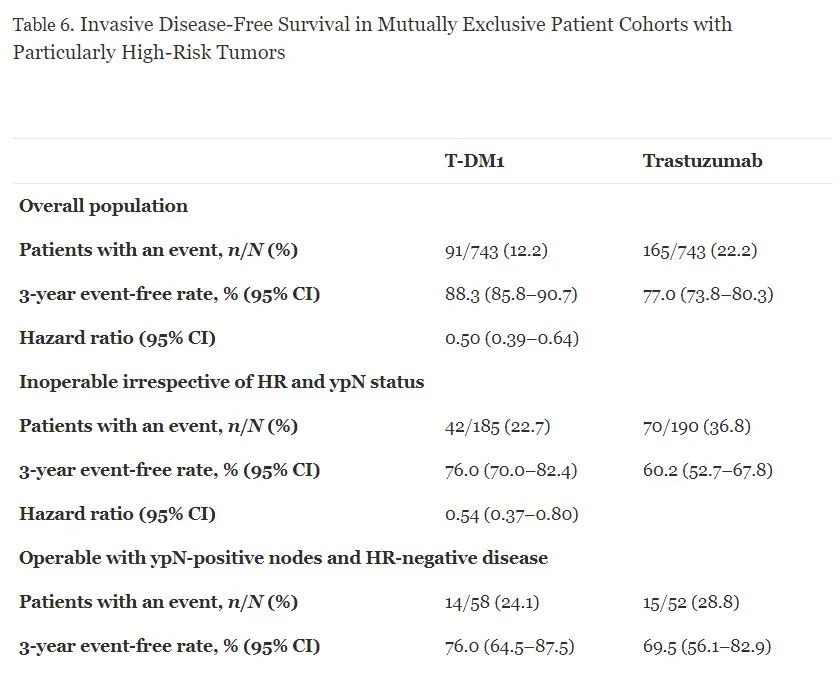
在特别高危患者队列中观察到T-DM1治疗后IDFS事件风险显著降低;然而,这些队列中T-DM1治疗的3年IDFS无事件率不同。
该分析的局限性包括通常与亚组分析相关的局限性,包括统计和方法学问题(例如,把握度低)以及与探索性分析相关的局限性(例如,偏倚风险)。然而,令人欣慰的是,这些探索性分析的安全性和疗效结果与主要研究的结果基本一致,并且在分析的所有亚组中均存在明显的T-DM1治疗效应。从这些结果中获得的见解将支持临床开始采用辅助T-DM1作为新辅助治疗后残留侵袭性疾病患者的新标准治疗。
内容来源:https://www.annalsofoncology.org/article/S0923-7534(21)01168-6/fulltext































